从Nature重磅研究,看免疫衰老的新型干预手段
随着人口老龄化不断加剧,年龄相关的免疫功能下降已成为全球公共健康面临的长期挑战。老年人更容易感染疾病、对疫苗反应不佳、肿瘤发生率明显升高,其根本原因并不只是“免疫力下降”,而是免疫系统整体结构和调控能力的退化。长期以来,科学界尝试通过多种方式延缓或逆转免疫衰老,但效果始终有限。
直到2025年12月17日,张锋教授团队在Nature发表论文:《Transient hepatic reconstitution of trophic factors enhances aged immunity》首次展示了一种全新的思路:利用mRNA技术,将肝脏暂时转化为“蛋白工厂”,系统性重建衰老免疫信号,从而显著改善老年个体的免疫功能。这项研究不仅刷新了我们对免疫衰老可逆性的认知,也将mRNA技术的价值从“疫苗平台”推向了全身免疫调控的新方向。
免疫衰老的核心问题:免疫源头退化
免疫衰老并非单一指标下降,而是一个多层级、系统性的过程:
-
胸腺萎缩:T细胞生成能力显著下降
-
TCR多样性减少:免疫系统识别新抗原的能力降低
-
关键信号通路减弱:Notch、FLT3L、IL-7等免疫营养信号随年龄衰退
-
慢性低度炎症背景升高:进一步抑制有效免疫反应
这意味着,单纯补“细胞”或“因子”,很难真正解决问题。
现有免疫补充手段:为什么始终难以突破?
在这项研究出现之前,针对免疫功能下降的干预大致集中在几类路径上:
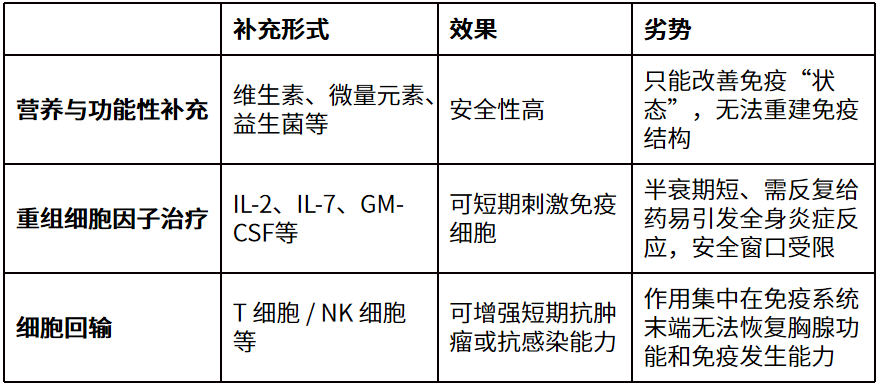
这些策略的共同特点是:在既有、已老化的免疫系统中“加东西”,而不是让系统重新生长。
突破性思路:让肝脏成为“临时免疫蛋白工厂”
张锋团队的研究选择了一条完全不同的路径。关键发现:免疫衰老伴随“免疫营养因子”系统性缺失。通过多组学分析发现,在老年小鼠中:Notch 通路(DLL1)、FLT3L 信号、IL-7 信号均显著下调,而这些信号正是维持 T 细胞发生、分化和功能的核心因素。
技术实现:mRNA + LNP 靶向肝脏递送
研究团队将编码DLL1、FLT3L 和 IL-7(合称 DFI)包封后的mRNA静脉注射后靶向肝脏。肝脏即使在高龄状态下,仍保持极强的蛋白合成能力,由此被“临时改造”为一个蛋白工厂,将所需免疫因子持续、温和地释放入血。
为什么是 mRNA?
与传统重组蛋白或细胞治疗相比,mRNA策略的优势在于其可控性:
可控、可逆:蛋白表达是瞬时的,停药后自然消退
更接近生理状态:体内合成并分泌,避免因子风暴
多因子协同:可同时重建多个免疫信号通路
高度可调:通过剂量和频率精确控制效应持续时间
这使得mRNA成为少数既能系统性调控免疫,又具备安全可控边界的技术路径。
文章实验结果显示:实验小鼠免疫系统真正“年轻化”
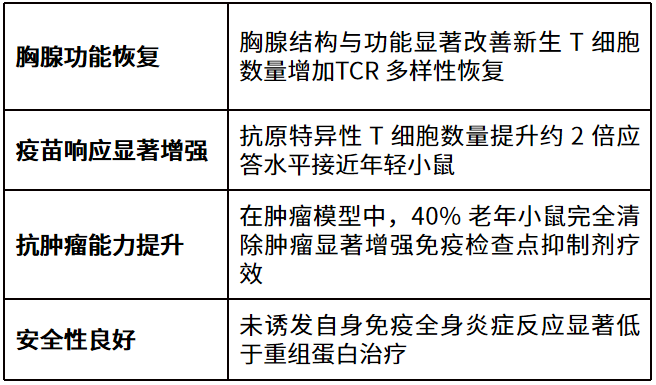
从科研突破到可转化技术,mRNA正在倒逼“底层能力”升级,谁在支撑mRNA技术走向长期应用?
值得注意的是,这类精细、系统性的 mRNA 免疫调控研究,并不仅仅依赖于生物学设计本身。从多因子mRNA的稳定表达、体内翻译一致性,到避免先天免疫过度激活,再到批次可重复性和放大能力,这些研究正在对RNA原料酶质量、酶体系稳定性以及整体工艺控制能力提出要求。
mRNA技术,正在从“概念突破”,走向真正的系统工程。在这一趋势下,mRNA项目的竞争力开始下沉到更基础的层面——RNA原料酶是否稳定、是否可放大、是否能长期供应。近年来,近岸蛋白持续投入RNA原料酶与mRNA全流程服务建设,从科研级到GMP级体系,支持了近20个EUA/IND项目。这类“底层能力”的积累,正成为mRNA技术从前沿研究走向临床转化的重要支撑。

图一.近岸蛋白mRNA酶及试剂产品线
结语|mRNA技术,正在成为免疫系统的“可编程工具”
从新冠疫苗,到如今的免疫衰老逆转研究,mRNA 技术的角色正在发生根本变化。它不再只是“替代某一种药物”,而是在逐步演变为一种重塑人体调控自身能力的平台技术。这项Nature研究清晰地表明:免疫系统,并非不可逆地走向衰老。而真正决定这条路径能走多远的,不仅是科学创意本身,更是mRNA这项技术反复被验证、被放大、被安全使用的底层能力。
参考文献
[1]Friedrich, M.J., Pham, J., Tian, J. et al. Transient hepatic reconstitution of trophic factors enhances aged immunity. Nature (2025).
